В хімічній науці є особлива галузь, яка вивчає швидкості і механізми різних реакцій,- хімічна кінетика.
Хоча хімічна теорія може пояснити багато чого, передбачити теоретично швидкість будь-якої реакції поки не можна. Її вивчають експериментально, в лабораторії, і потім розробляють способи, як цю швидкість змінити. Є чимало реакцій, важливих для промисловості, які йдуть надто повільно, потрібно вміти їх прискорювати. Інші реакції, навпаки, доводиться гальмувати, тому що вони шкідливі.
Словом, хімічна кінетика - експериментальна наука. У справедливості її законів можна переконатися, поставивши кілька нескладних дослідів.
Для початку переконаємося в тому, що швидкість однієї і тієї ж реакції дійсно може змінюватися, і досить значно. (Втім, це можна припустити на підставі не хімічне, а життєвого досвіду; наприклад, продукти на морозі псуються повільніше, ніж на спеці, тому що при різних температурах одні і ті ж біохімічні реакції йдуть з різними швидкостями.)
Для перевірки повторіть досвід з голови «Хімічні годинник», але змінюйте на цей раз не концентрації речовин (це вам вже знайомо), а температуру. Якщо обидва вихідних розчину сульфату натрію та йодату калію із сірчаною кислотою - виливати у воду з льодом, то часу до появи синього забарвлення пройде помітно більше, ніж при використанні теплої води. Зауважте тільки, що в дуже гарячій воді забарвлення не з'являється зовсім, так як забарвлене з'єднання йоду з крохмалем хитливо.
Отже, ви з'ясували на досвіді: чим вище концентрація і температура, тим швидше йде реакція. Але деякі реакції на перший погляд здаються винятком з правила. Ось приклад.
Налийте в пробірку на висоту 1-2 см оцтової кислоти і киньте в неї кілька шматочків цинку. Цинк треба попередньо очистити, зануривши його секунд на двадцять в розчин соляної кислоти і промивання водою.
Оцтова кислота слабка, і цинк розчиняється в ній дуже повільно - бульбашки водню ледве виділяються. Як прискорити реакцію? Нагріти розчин. Правильно. А чи не можна інакше? Зробимо так: потроху будемо додавати в пробірку чисту воду, кожен раз добре перемішуючи. Уважно постежите за бульбашками. Дивна річ: кислота вже розбавлена вдвічі, втричі, а реакція замість того щоб сповільнюватися, йде все швидше!
Якщо ви ставите цей досвід на заняттях гуртка, то замініть цинк маленьким шматочком магнієвої стружки і нічим її не обробляйте. З розведеною оцтовою кислотою магній реагує ще енергійніше, ніж цинк.
Таке «виключення» з правила стає зрозумілим, якщо його добре вивчити. Наш досвід з оцтовою кислотою пояснюється наступним чином. Швидкість, з якою цинк або магній взаємодіють з кислотою, залежить від концентрації іонів водню в розчині. Ці іони утворюються при розчиненні у воді будь-якої кислоти. Але коли води мало, слабка оцтова кислота знаходиться в розчині майже виключно у вигляді недиссоциированных молекул. У міру розведення водою все більше молекул оцтової кислоти розпадається на іони, і реакція йде швидше. Але якщо додати занадто багато води, то реакція знову сповільниться, вже з іншої причини: з-за сильного розведення концентрація іонів водню знову зменшиться. Найшвидше реагує з цинком 15%-ная оцтова кислота.
Звичайно, ми розібрали цей досвід зовсім не заради того, щоб просто показати, якими незвичайними бувають хімічні перетворення. Ми хотіли звернути вашу увагу ось на що: для керування швидкістю реакції обов'язково треба знати, як вона йде.
Всяка реакція починається з того, що молекули речовин стикаються один з одним. Подивимося, як починається реакція.
Візьміть не дуже широку скляну трубку довжиною в кілька десятків сантиметрів і підберіть до неї дві пробки. З внутрішньої сторони, зверненої до трубки, вставити в обидві пробки по невеликому скляному стерженьку і намотайте на них по шматочку вати. Один шматочок змочіть декількома краплями концентрованої соляної кислоти, інший - концентрованим розчином аміаку. Одночасно вставте пробки з ватками в трубку з обох кінців. Через кілька хвилин, в залежності від довжини трубки - в ній, ближче до ватці з соляною кислотою, з'явиться біле кільце хлориду амонію NH4Cl.
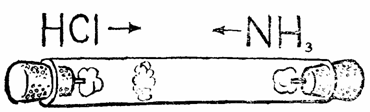
Зазвичай при хімічних реакціях суміш перемішують, щоб процес йшов швидше. Ми навмисне цього не зробили і не намагалися навіть допомогти молекулам зустрітися - вони рухалися самі. Таке самостійне пересування молекул в тій чи іншій середовищі називають дифузією. Випаровуючись з вати, молекули обох речовин відчували мільярди зіткнень в секунду з молекулами повітря та один з одним. І хоча швидкість молекул дуже велика, вона обчислюється сотнями метрів в секунду, при 0°С і нормальному тиску вільний пробіг, тобто відстань, яку встигає пройти молекула від однієї сутички до іншої, складає для цих речовин всього близько 0,0001 мм . Тому-то аміак і хлористий водень (соляної кислоти) так повільно рухалися в трубці. Настільки ж повільно поширюється по кімнаті з нерухомим повітрям пахуче речовина.
Але чому біле кільце з'явилося не посередині трубки? Тому, що молекули аміаку менше, вони просуваються через повітря швидше. Якщо ж з трубки відкачати повітря, то молекули аміаку і хлористого водню зустрінуться через частки секунди - довжина вільного пробігу молекул значно збільшиться.
Радимо вам самостійно провести невелике дослідження, щоб дізнатися, як впливають на дифузію сили тяжіння і температура. Для цього розташовуйте трубку вертикально, похило, а також нагрівайте окремі її частини (включаючи те місце, де осідає хлорид амонію). Висновки спробуйте зробити самі.
Від газів перейдемо до рідин. У них дифузія йде ще повільніше. Перевіримо це на досвіді.
На гладку і чисту скляну пластинку капніть поруч по кілька крапель трьох рідин: в середині - води, по боках від неї - розчинів соди і соляної кислоти. Рідини до початку досліду не повинні стикатися. Потім дуже обережно, уникаючи перемішування, паличкою з'єднайте розчини. Повинен виділятися діоксид вуглецю, але це відбудеться не відразу. А коли газ почне виділятися бульбашки його розташуються уздовж кордону, що розділяє області дифузії кислоти і соди.
Замість соди і кислоти можна взяти два будь-яких розчинних у воді речовини, які при змішуванні фарбуються або дають осад. Втім, у таких дослідах важко уникнути потоків рідини, що спотворюють картину, тому краще ставити досліди в загущених розчинах. А загущати їх можна желатиной.
Приготуйте 4%-ний розчин желатини, опустивши її в гарячу воду (не кип'ятити!). Гарячий розчин налийте в пробірку і, коли він охолоне, в центр пробірки швидко, одним рухом, введіть пінцетом кристалик перманганату калію, мідного купоросу або іншого яскраво пофарбованого і розчинної у воді речовини. Пінцет одразу ж вийміть обережним, але швидким рухом. Протягом декількох годин можна спостерігати дуже красиву картину дифузії. Растворяемое речовина поширюється в усіх напрямках з однаковою швидкістю, утворюючи забарвлену сферу.
З загущене розчином можна поставити ще один досвід. Налийте гарячу желатиновий розчин у дві пробірки і додайте в одну трохи розчину лугу, а в іншу - фенолфталеїну. Коли вміст пробірок застигне, пінцетом швидко введіть в центр першої пробірки шматочок таблетки фенолфталеїну, в центр другій - грудку кальцинованої соди. В обох випадках з'явиться малинове забарвлення. Але зауважте: у другій пробірці забарвлення розповсюджується набагато швидше. Іони гідроксиду, що утворилися при дисоціації луги, набагато менше і легше складної органічної молекули фенолфталеїну, і тому вони рухаються в розчині швидше.
Перейдемо тепер до твердих речовин. В реакціях між ними (або між твердим речовиною з рідиною або газом) молекули можуть стикатися тільки на поверхні. Чим більше поверхня розділу, тим швидше йде реакція. Переконаємося в цьому. Залізо на повітрі не горить. Однак це справедливо тільки для залізних предметів. Наприклад, у цвяхів поверхню стикання з повітрям невелика, реакція окислення йде занадто повільно. Залізні ошурки реагують з киснем набагато швидше: на холоді раніше перетворюються на іржу, а в полум'ї можуть загорітися. Дрібні ж крупинки здатні спалахнути взагалі без нагрівання. Таке залізо називають пирофорным. Його неможливо настругати навіть самим дрібним напилком, так що отримують його хімічним шляхом, наприклад, розкладаючи сіль щавлевої кислоти - оксалат заліза.
Змішайте водні розчини якої-небудь солі двовалентного заліза, наприклад залізного купоросу, і щавлевої кислоти або її розчинної солі. Жовтий осад оксалату заліза відфільтруйте і заповніть їм пробірку не більше ніж на п'яту частину обсягу. Нагрійте речовина в полум'ї пальника, при цьому тримайте пробірку горизонтально або трохи похило, отвором вниз і в бік від себе. Виділяються краплі води знімайте джгутом фільтрувального паперу або ватою. Коли оксалат розкладеться і перетвориться в чорний порошок, закрийте пробірку і охолодіть її.
Потроху і дуже обережно висипайте вміст пробірки на металевий або азбестовий лист: порошок буде спалахувати яскравими іскрами. Особливо ефектний досвід в затемненому приміщенні.
Важливе попередження: пирофорное залізо не можна зберігати, це може призвести до пожежі! По закінченні досвіду порошок обов'язково прожарити на повітрі або обробіть кислотою, щоб не залишилося незгорілих частинок - вони можуть самозайматися.
Далі досліджуємо, як впливає розмір поверхні твердої речовини на швидкість його реакції з рідиною. Візьміть два однакових шматочка крейди і один з них розітріть в порошок. Помістіть обидва зразка в пробірки і залийте однаковими обсягами соляної кислоти. Мелкораздробленный крейда, як і слід було очікувати, розчиниться набагато швидше. Ще один шматочок крейди помістіть у пробірку з сірчаною кислотою. Почалася було енергійна реакція незабаром затихає, а потім і зовсім припиняється. Чому ж? Адже сірчана кислота не слабкіше соляної.
При реакції крейди з соляною кислотою утворюється хлорид кальцію СаСl2 який легко розчиняється у воді і не заважає притоку до поверхні крейди нових порцій кислоти. При взаємодії з сірчаною кислотою виходить сульфат кальцію CaSO4, а він дуже погано розчиняється у воді, залишається на поверхні крейди і закриває її. Щоб реакція пішла далі, треба час від часу очищати поверхню крейди або заздалегідь перетворити його в порошок. Знання таких подробиць процесу дуже важливо для хімічної технології.
І ще один досвід. Змішайте в ступці два твердих речовини, що дають забарвлені продукти реакції: нітрат свинцю і іодіда калію, залізний купорос і червону кров'яну сіль, і т. д. і розітріть суміш товкачиком. Поступово, по мірі розтирання, суміш почне забарвлюватися, так як поверхня взаємодії речовин збільшується. Якщо ж налити на суміш трохи води, то відразу з'явиться інтенсивне забарвлення - адже в розчині молекули пересуваються значно легше.
І на закінчення дослідів по кінетиці поставимо кількісний експеримент; єдиний інструмент, який вам знадобиться,- це секундомір або годинник з секундною стрілкою.
Приготуйте 0,5 л 3%-ного розчину сірчаної кислоти (лити кислоту у воду!) і стільки ж 12%-ного розчину тіосульфату натрію. Перед розчиненням тіосульфату додайте у воду кілька крапель нашатирного спирту.
На дві циліндричні склянки (стакани, стопки) місткістю 100 мл нанесіть мітки на рівні 50; 25; 12,5 і 37,5 мл, послідовно розділяючи висоту навпіл. Позначте склянки і налийте в них до верхніх міток (50 мл) приготовлені розчини.
Звичайний тонкий стакан місткістю 200 або 250 мл поставте на темну папір і вилийте в нього розчин тіосульфату, а потім - кислоти. Відразу зауважте час і перемішуйте суміш протягом однієї-двох секунд. Щоб не розбити склянку, краще користуватися дерев'яною паличкою. Як тільки розчин почне мутніти, запишіть час, що минув з початку реакції. Досвід зручно проводити вдвох: один стежить за годинами, інший зливає розчини і сигналізує про помутнінні.
Вимийте склянку і проведіть досвід ще тричі; розчин тіосульфату наливайте в склянку до третьої (37,5), другий (25) та першої (12,5 мл) міток, доливаючи кожен раз воду до верхнього ділення. Кількість кислоти у всіх дослідах залишається постійним, і загальний об'єм реагуючої суміші завжди дорівнює 100 мл.
Тепер накресліть графік: як залежить швидкість реакції від концентрації тіосульфату. Концентрацію зручно виразити в довільних одиницях: 1, 2, 3 і 4. Відкладіть їх на осі абсцис. Але як підрахувати швидкість реакції?
Точно це зробити не можна хоча б тому, що момент помутніння ми визначаємо на око, певною мірою суб'єктивно. До того ж помутніння показує тільки, що найдрібніші частинки сірки, які виділяються в ході реакції, досягли такого розміру, що їх можна помітити. І все ж, за браком кращого, приймемо початок помутніння за закінчення реакції (що, до речі, не дуже далеко від істини). Зробимо ще одне припущення: швидкість реакції обернено пропорційна її тривалості. Якщо реакція йшла 10 секунд, то будемо вважати, що швидкість дорівнює 0,1. Відкладіть швидкості на осі ординат.
Чотири досвіду дали чотири точки, п'ята - початок координат. Всі п'ять точок розташуються приблизно на одній прямій. Її рівняння записується так:
v == k [Na2S2O3]
де v - швидкість реакції, квадратні дужки - прийняте в хімічній кінетиці позначення концентрації, а k - константа швидкості, яку легко знайти з графіка.
Але швидкість реакції повинна залежати і від концентрації сірчаної кислоти. Залишаючи кількість тіосульфату незмінним і розбавляючи сірчану кислоту, перевірте, як змінюється швидкість реакції. Як не дивно, вона не змінюється!
Такі випадки не рідкість. У нашому досвіді йде складна реакція, і її продукт - сірка виділяється не відразу при безпосередніх зіткненнях молекул тіосульфату і кислоти. І взагалі реакцій, де продукти виходять відразу, не так вже й багато.
У складних послідовних реакціях якась стадія протікає повільніше інших. У нашому випадку - остання, в якій і утворюється сірка. Саме її швидкість ми, по суті справи, і вимірювали.
О. Ольгин. "Досліди без вибухів"
М., "Хімія", 1986