На цій сторінці ви знайдете найпростіші досліди з електрикою. Щоб провести їх, достатньо трьох-чотирьох батарейок для кишенькового ліхтаря.
Взагалі-то досліди з електрохімії часто намагаються ставити вдома, але не завжди вони виходять: яка-небудь дрібничка - і нічого не виходить. Якщо ви будете слідувати всім нашим вказівкам, можете бути впевнені, що досвід вдасться.
ДОСВІД № 1
ЧОРНИЛО ПІД ДІЄЮ СТРУМУ
Почнемо з дуже простого, але тим не менш повчального досвіду. Для нього знадобиться один-єдиний реактив: чорнило будь-якого кольору. Правда, доведеться трохи попрацювати над приладом.
Візьміть дві металеві смужки довжиною 8-10 см і шириною 1-2 див. Вони можуть бути із заліза, міді, алюмінію - байдуже, аби вільно проходили у прозору посудину - високу мензурку або велику пробірку. Перед досвідом просвердліть у пластинах з одного боку отвори для прикріплення провідників. Приготуйте дві однакові, товщиною в кілька міліметрів, пластмасові або дерев'яні прокладки і склейте їх з металевими смужками так, щоб ті, розташувавшись паралельно, не торкалися один одного. Клей годиться практично будь - БФ «Момент» та ін.
В мензурку або пробірку налийте воду і капніть в неї стільки чорнила, щоб розчин не був дуже насиченого кольору (проте він не повинен бути прозорим). Опустіть в нього конструкцію з двох смужок, з'єднайте їх проведеннями з двома батарейками, підключені послідовно, «плюс» до «мінуса». Кілька хвилин потому, чорнильний розчин між пластинками стане світлішати, а на дні і вгорі будуть збиратися темні частинки.
Чому так відбувається?
До складу чорнило входять дуже дрібні пофарбовані частки, зважені у воді. Під дією струму вони злипаються і не можуть плавати у воді, а опускаються на дно під дією сили тяжіння. Зрозуміло, що розчин при цьому стає все більш і більш блідим.
Але як же частинки потрапили наверх? При дії струму на розчини нерідко утворюються гази. У нашому випадку газові бульбашки підхоплюють тверді частинки і забирають їх наверх.
ДОСВІД № 2
ОТРИМАННЯ ГАЗІВ - ВОДНЮ, КИСНЮ І ХЛОРУ - В ДОМАШНІХ УМОВАХ
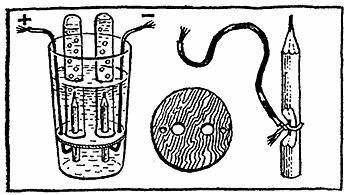 В наступному досвіді товстостінний чайний стакан, що розширюється догори, буде служити електролітичній ванні. Приготуйте фанерний гурток такого діаметру, щоб він притиснувся до стінки склянки в трьох-чотирьох сантиметрах вище дна. В гуртку заздалегідь просвердліть два отвори (або виріжте в ньому по діаметру проріз), неподалік шилом проколіть два отвори: через них будуть проходити проводки. У великі отвори або в проріз вставити два олівця довжиною 5-6 см, очиненные з одного кінця. Олівці, точніше, їх пасти, будуть служити електродами. На неочиненных кінцях олівців зробіть зарубки, щоб оголилися грифелі, і примотати до них оголені кінці проводів. Проведення скрутіть і ретельно обмотайте ізоляційною стрічкою, а щоб ізоляція була зовсім надійною, найкраще заховати проводки в гумових трубках. Всі деталі приладу готові, залишається тільки зібрати його, тобто вставити гурток з електродами всередину склянки.
В наступному досвіді товстостінний чайний стакан, що розширюється догори, буде служити електролітичній ванні. Приготуйте фанерний гурток такого діаметру, щоб він притиснувся до стінки склянки в трьох-чотирьох сантиметрах вище дна. В гуртку заздалегідь просвердліть два отвори (або виріжте в ньому по діаметру проріз), неподалік шилом проколіть два отвори: через них будуть проходити проводки. У великі отвори або в проріз вставити два олівця довжиною 5-6 см, очиненные з одного кінця. Олівці, точніше, їх пасти, будуть служити електродами. На неочиненных кінцях олівців зробіть зарубки, щоб оголилися грифелі, і примотати до них оголені кінці проводів. Проведення скрутіть і ретельно обмотайте ізоляційною стрічкою, а щоб ізоляція була зовсім надійною, найкраще заховати проводки в гумових трубках. Всі деталі приладу готові, залишається тільки зібрати його, тобто вставити гурток з електродами всередину склянки.
Поставте склянку на тарілку і налийте в нього до країв розчин пральної кальцинованої соди Na2CO3 з розрахунку 2-3 чайні ложки на склянку води. Таким же розчином заповніть дві пробірки. Одну з них закрийте великим пальцем, переверніть догори дном і занурте в склянку так, щоб у неї не потрапив жоден пухирець повітря. Під водою надіньте пробірку на електрод-олівець. Точно так само поступите з другої пробірки.
Батарейки - числом не менше трьох - потрібно з'єднати послідовно, «плюс» однієї до «мінуса» іншого, а до крайніх батареям під'єднати проводки від олівців. Відразу почнеться електроліз розчину. Позитивно заряджені іони водню Н+ попрямують до негативно зарядженого електроду - катода, приєднають там електрон і перетворяться на газ водень. Коли у олівця, приєднаного до «мінуса», збереться повна пробірка водню, її можна вийняти і, не перевертаючи, підпалити газ. Він загориться з характерним звуком. У іншого електрода, позитивного (анода), виділяється кисень. Наповнену їм пробірку закрийте пальцем під водою, вийміть з склянки, переверніть і внесіть тліючу лучинку - вона спалахне.
Отже, з води Н2Про вийшов і водень Н2, і кисень Про2; а для чого ж сода? Для прискорення досвіду. Чиста вода дуже погано проводить електричний струм, електрохімічна реакція йде в ній занадто повільно.
З тим же приладом можна поставити ще один досвід - електроліз насиченого розчину кухонної солі NaCl . В цьому випадку одна пробірка наповниться безбарвним воднем, а інша - жовто-зеленим газом. Це хлор, який утворюється з кухонної солі. Хлор легко віддає свій заряд і першим виділяється на аноді.
Пробірку з хлором, у якій знаходиться також трохи розчину солі, закрийте пальцем під водою, переверніть і струсніть, не віднімаючи пальця. У пробірці утворюється розчин хлору - хлорна вода. У неї сильні відбілюючі властивості. Наприклад, якщо додати хлорну воду до блідо-синього розчину чорнила, то він знебарвиться.
При електролізі кухонної солі утворюється ще одна речовина - їдкий натр. Ця луг залишається в розчині, в чому можна переконатися, капнувши в склянку біля негативного електрода трохи розчину фенолфталеїну або саморобного індикатора.
Отже, ми отримали в досвіді відразу три цінні речовини - водень, хлор і їдкий натр. Саме тому електроліз кухонної солі так широко використовують у промисловості.
ДОСВІД № 3
СВЕРДЛИМО МЕТАЛИ ОЛІВЦЕМ...
З допомогою струму і насиченого розчину кухонної солі можна проробити ще один цікавий досвід. Займемося зараз тим, що будемо свердлити метал звичайним олівцем.
Приготуйте чайне блюдце насичений розчин кухонної солі. З'єднайте дротом лезо безпечної бритви з позитивним полюсом батарейки для кишенькового ліхтаря (лезо буде анодом). На заточенном кінці олівця обломайте грифель і приблизно на півміліметра выковыряйте його голкою. На 2-3 см вище зробіть ножем карб до грифеля і намотайте на кінець оголеного дроту; це місце оберніть ізоляційною стрічкою, а інший кінець дроту приєднайте до негативного полюса батареї (олівець буде катодом).
Покладіть лезо в блюдце з розчином і торкніться олівцем-катодом леза. Зараз навколо олівця почнуть бурхливо виділятися пухирці водню. А лезо-анод буде розчинятися: атоми заліза придбають заряд, перетворяться на іони і перейдуть у розчин. Так хвилин через 10-15 на лезі вийде наскрізний отвір. Особливо швидко вона утвориться, якщо батарея нова, а лезо тонке (0,08 мм). У алюмінієвої ж фользі просвердлюється отвір буквально за секунди.
Якщо ви захочете просвердлити олівцем отвір у визначеному місці тонкої металевої пластинки, то краще заздалегідь покрити оброблювану деталь лаком, а там, де ви будете свердлити, лак зняти.
Поглиблення в грифеле знадобилося потім, щоб грифель не торкався металу. Інакше ланцюг відразу замкнеться, струм не піде через розчин і ніякого електролізу не буде.
Свердлити олівцем можна і без електролітичної ванни (в нашому випадку, без чайного блюдця). Платівку-анод покладіть на дошку або на тарілку, капніть води, умочіть олівець, приєднаний до батарейці, сіль і занурте заточений його кінець в краплю. Час від часу видаляйте ганчірочкою продукти електролізу та наносити нову краплю. Повторюючи цю операцію, можна, не прикладаючи зусиль, просвердлити металеву фольгу або жерсть від консервної банки. Так само, між іншим, можна зробити отвір в зламаному сталевому ножі, щоб приробити до нього нову ручку.
Звичайно, для свердління металу товщиною більше міліметра однієї батарейки мало - треба включити паралельно кілька батарейок або скористатися знижувальним трансформатором з випрямлячем - наприклад, від дитячої залізниці або від приладу для випалювання по дереву. І незалежно від джерела струму та способу електролізу доведеться кілька разів міняти розчин електроліту і добре очищати лунку - цвяхом або шилом.
О. Ольгин. "Досліди без вибухів"
М., "Хімія", 1986